MSDS/산안법
건강기능식품
의약외품
화장품법
전파인증
고객후기
 의약품 인허가절차
의약품 인허가절차
의약품 품목 허가 절차 안내
의약품 품목허가 절차
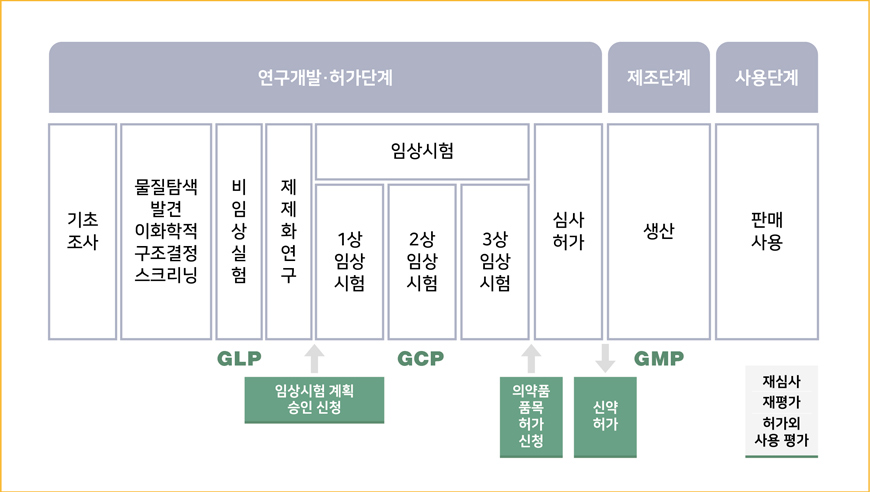
의약품을 제조하거나 판매하기 위해서는 국가 규제기관(예: 식약처, FDA, EMA 등)의 품목허가를 받아야 합니다. 허가 절차는 제품의 안전성과 유효성을 검증하는 데 중점을 둡니다.
주요 단계
1. 비임상시험 : 독성 평가 및 효능 시험을 통해 안전성 확인
2. 임상시험 : 사람을 대상으로 한 안전성과 효능 검증 (1상, 2상, 3상 시험)
3. 허가 신청 : 완성된 기술문서(CTD)를 제출하여 규제기관 검토
4. GMP 인증 : 제조 및 품질관리 기준에 부합하는 생산시설 평가
5. 허가 획득 : 모든 기준을 충족하면 품목허가 발급
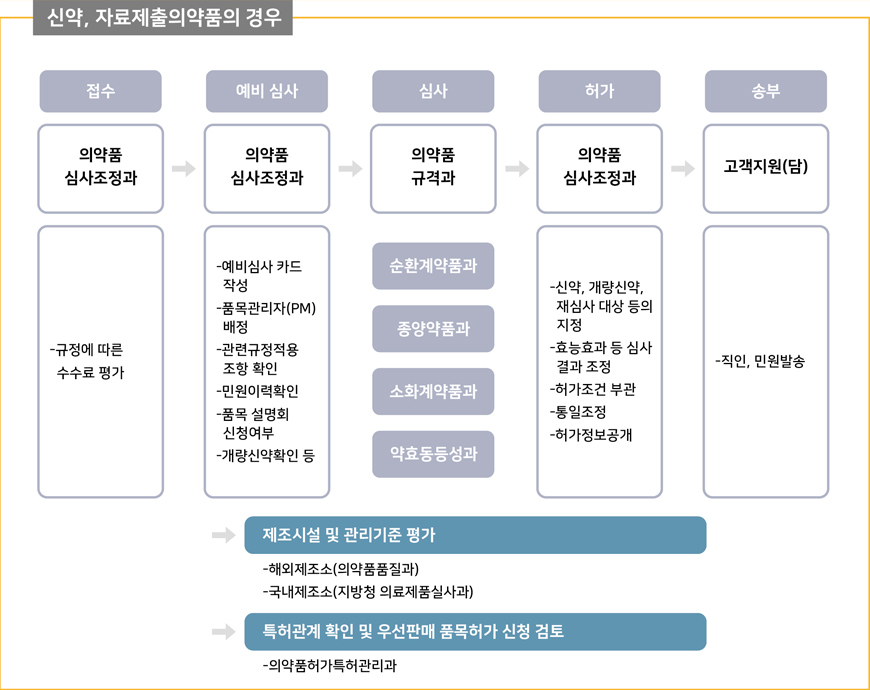
제출서류
-의약품 기술문서(CTD): 품질, 비임상, 임상 관련 자료 포함
-제조시설의 GMP 인증서
-제품 안정성 시험 결과
의약품 개발부터 사용까지 전주기 체계도
허가 업무 흐름도
법적 미준수 시 조치 및 제재





